OXANDROLONE
Per approfondimenti consultare il libro: Longevity: il segreto degli ormoni. Di Vittorio Bianchi
Generalità
L’oxandrolone è uno degli androgeni più conosciuto ed usato per le sue caratteristiche terapeutiche e la ottima tolleranza. E’ l’unico androgeno utilizzato in pediatria perché che non ha tossicità. Possiede un ottimo effetto stimolante la sintesi proteica nei tessuti, in particolare a livello muscolare, epatico e nervoso.
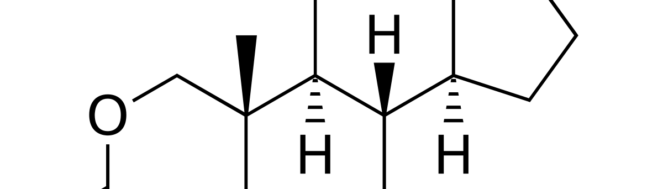
E’ uno steroide anabolizzante sintetico, non aromatizzabile, commercializzato dalla Searle, con il nome commerciale e sintetizzato negli USA nel 1962 (Fox, Minot et al. 1962). L’oxandrolone appartiene alla classe di androgeni 17α-alchilati, cioè che hanno un gruppo alchilico in posizione 17. Questa classe di androgeni comprende l’oximetolone, lo stanazololo, metil-testosterone, metandienone, danazolo, noretandrolone e fluoximesterone. L’oxandrolone viene assorbito molto bene per via orale, la sua emivita è di 30 minuti e viene eliminato in 9 ore (Karim, Ranney et al. 1973). A differenza di tutti gli altri androgeni che sono metabolizzati rapidamente, l’oxandrolone è resistente alla trasformazione e viene eliminato in forma immodificata nelle urine (Karim, Ranney et al. 1973).
Tuttavia, senza motivi particolari, l’oxandrolone venne ritirato dal commercio nel 1989 e reintrodotto nel 1995 nel mercato con il nome commerciale Oxandrin. E’ stato approvato dalla FDA per la cura dell’epatite alcolica, la sindrome di Turner, la perdita di peso da HIV. Inoltre, è utilizzato con risultati positivi anche nel trattamento dell’anemia, delle ustioni, della sarcopenia e nell’angiodema ereditario.
Introduzione.
L’oxandrolone è uno steroide di Classe I, cioè che significa che la maggior parte dei suoi effetti sono dovuti ad una diretta interazione del composto con il recettore androgeno (RA), e spiga anche la scarsità dei suoi effetti collaterali in confronto ad altri steroidi androgeni. Notoriamente, l’oxandrolone è considerato un debole agente anabolizzante. Come già accennato, l’oxandrolone è alchilato in posizione 17α, che lo protegge da una estesa demolizione della molecola dopo l’assunzione, come avviene per il testosterone, e ne prolunga considerevolmente la vita-media (9 ore vs.10-20 min del testosterone), ma diminuisce la capacità dello steroide di legarsi al recettore androgeno. I due effetti si bilanciano, così che si ritiene che l’oxandrolone sia una molecola fisiologicamente attiva. Queste modificazioni sono le più favorevoli per il dosaggio orale. Il fegato non può metabolizzare bene questo tipo di steroide, una larga percentuale di esso viene veicolata nel sangue immodificata e come tale escreta a livello renale. Una quantità più ridotta di oxandrolone viene metabolizzata a livello epatico e, pertanto, può esercitare una modesta attività su questo organo. L’introduzione dell’atomo di ossigeno nell’anello A dello steroide ne impedisce la aromatizzazione e esclude la formazione di metaboliti dotati di attività estrogena, responsabili per un accumulo indesiderato di liquidi, anche in presenza di una dieta a basso contenuto calorico. Un altro vantaggio di questo steroide androgeno è la sua scarsa attività ad influenzare negativamente, per meccanismo di feed-back, la produzione dell’ormone endogeno naturale, testosterone, evitando la conseguente soppressione della funzione gonadica (Bruggemeier,2005).
EFFETTI CLINICI DELL’ OXANDROLONE
L’oxandrolone ha una marcata attività anabolica ed un modesto effetto androgeno (Jackson, Rallison et al. 1973, Link, Blizzard et al. 1986). In confronto al testosterone, l’oxandrolone ha una rapporto effetto anabolico rispetto a quello androgeno di 10 (Kuhn 2002). Negli studi sperimentali su animali l’oxandrolone ha dimostrato una tossicità minima nel ratto e nel gatto (Fox, Minot et al. 1962) per la ragioni precedentemente discusse.
Le indicazione dell’oxandrolone sono in quei pazienti che necessitano di un sostegno anabolico, quindi in quei pazienti affetti da denutrizione, trauma o malattie croniche come gravi traumi e interventi chirurgici importanti, ustioni, infezioni da HIV, malattie neuromuscolari, epatite alcolica e malattie croniche debilitanti ingenerale. Negli Usa l’oxandrolone è l’unico steroide androgeno approvato dalla FDA. La maggioranza dei pazienti studiati sono quelli affetti da malattie croniche come l’epatite cronica e le ustioni e tutti gli studi riportano significati miglioramenti dello stato di salute dei pazienti e della loro sopravvivenza. Inoltre nessuna o lieve tossicità è stata riportata (Orr and Fiatarone Singh 2004). Il periodo di cura era mediamente di 4,5 mesi con una dose giornaliera da 5 a 20 mg al dì.
Nelle malattie cataboliche acute (per stato catabolico si intende la perdita di proteine dai tessuti muscolare, osseo, organi) come nell’epatite alcolica e nelle ustioni la gravità delle complicazioni correlate con la perdita di proteine determina un aumentato rischio di mortalità e morbilità. Il trattamento con oxandrolone determina un significativo aumento della sintesi proteica e aumenta l’utilizzo degli aminoacidi da parte della cellula, migliora il tempo di guarigione delle ferite e aumenta l’efficienza fisica, diminuisce le complicazioni e riduce la mortalità.
Anche sulle malattie croniche, come le malattie epatiche croniche, l’oxandrolone migliora l’efficienza e la funzionalità del fegato, come pure nella malattia cronica ostruttiva polmonare cronica (COPD) è importante nel migliorare la riabilitazione polmonare. Particolarmente utile èl’impiego dell’oxandrolone nell’atrofia muscolare e nella sarcopenia
Un’altra grande indicazione clinica dell’oxandrolone riguarda i pazienti affetti da HIV/AIDS(Orr and Fiatarone Singh 2004). Tutti gli studi riportano un significativo miglioramento della stato fisico, dell’aumento della massa muscolare, dell’appetito e del recupero. I pazienti assumevano 15 mg al di dì oxandrolone per 4 mesi (Romeyn and Gunn 2000). Strawford e coll. ha dimostrato che l’associazione di oxandrolone 20 mg al dì per 2 mesi associato ad un programma di esercizio di resistenza da i migliori risultati sul recupero dello stato fisico e muscolare (Strawford, Barbieri et al. 1999).
Nelle malattie neuromuscolari come la sclerosi laterale amiotrofica (SLA) la terapia con oxandrolone ha dimostrato benefici significativi sul mantenimento della massa muscolare e sulla motricità (Rosenfeld, King et al. 2000) come pure nella distrofia muscolare, la malattia di Duchenne (Fenichel, Pestronk et al. 1997).
Impiego terapeutico nei bambini.
L’uso dell’oxandrolone per la sua scarsa tossicità è soprattutto indicato nei bambini per la stimolazione della crescita e dell’apprendimento. Molti studi sono stati condotti con l’impiego di oxandrolone nei bambini maschi e femmine, prevalentemente affette da sindrome di Turner (Menke, Sas et al. 2010, Gault, Perry et al. 2011, Zeger, Shah et al. 2011) (Ross, Mazzocco et al. 2009) (Przkora, Herndon et al. 2007). Sono stati dimostrati risultati positivi sulla crescita, specie nei ritardi di sviluppo, praticamente nessun effetto collaterale.
La terapia con oxandrolone è stata associate anche ad altri androgeni, come il testosterone in bambini affetti da ritardo di crescita e di sviluppo evidenziando un effetto positivo sullo sviluppo fisico e la crescita, una aumentata secrezione di GH e IGF1. In tutti gli studi si è riscontrata una buona tolleranza della terapia e l’assenza di effetti collaterali (Crowne, Wallace et al. 1997) (Crowne, Wallace et al. 1995, Schmitt, Hausler et al. 1997, Lampit and Hochberg 2003)
Oxandrolone associato al GH.
Vari studi hanno utilizzato la terapia con oxandrolone associato al GH per lo sviluppo dell’altezza nei bambini normali (Zeger, Shah et al. 2011) e affetti da sindrome di Turner (Menke et al. 2010) (Stahnke, Keller et al. 2002) (Menke, Sas et al. 2010). In ragazze in trattamento con GH la associazione di terapia con oxandrolone alla dose di 0.03 mg/kg/dì non sono stati evidenziati effetti virilizzanti o di cambiamento del comportamento psicologico e senza effetti collaterali (Menke, Sas et al. 2010)(Joss, Mullis et al. 1997, Menke, Sas et al. 2010)(Haeusler, Schmitt et al. 1996).
Loche e coll. hanno evidenziato che in ragazzi con ritardo di sviluppo costituzionale la terapia con oxandrolone alla dose di 0.07 mg/kg al dì per sei mesi è ugualmente efficace alla somministrazione di GH 0.6 U/kg a settimana nel determinare un aumento dello sviluppo fisico (Loche, Pintor et al. 1991). L’ effetto positivo dell’oxandrolone sulla altezza finale anche nella sindrome di Turner è stato confermato (Crock, Werther et al. 1990).
Tuttavia, quest’ultime non dovrebbero assumerlo consecutivamente per un prolungato periodo di tempo, per evitare disturbi di origine epatica e manifestazioni virilizzanti. Anche se incapace di stimolare la crescita muscolare di per sé, l’oxandrolone può migliorare l’azione sul trofismo muscolare esercitata da altri steroidi. Queste combinazioni di trattamenti steroidei intervallati (stacking) vengono soprattutto perseguite da atleti e culturisti, e hanno usato l’oxandrolone efficacemente combinato con il testosterone decanoato (Andriol), il fuoximesterone (Holetestin), il nandrolone decanoato (Deca Durabolin), il Clembuterolo, un antagonista β2-adrenergico dotato di attività anabolizzante (vedi Roberts, 2006).
Proprietà tossicologica
L`Oxandrolone (17 beta-idrossi-17-metil-2-oxa-5 alfa-androstan-3-one) è uno steroide attivo per via orale con spiccata attività anabolizzante proteica, marcatamente superiore a quella del metiltestosterone e dello stesso testosterone propionato, e con un`attività androgena nettamente inferiore, in assenza di effetti inibitori sulla funzionalità ipofisaria. Il preparato stimola inoltre il metabolismo del calcio favorendo nel tessuto osseo la formazione della matrice e la mineralizzazione. Gli studi tossicologici hanno permesso di dimostrare che l`oxandrolone possiede una bassissima tossicità acuta (DL50 > 4g/kg sia per os che per via i.p. in topi, ratti e conigli) e che anche la somministrazione sub-cronica (ratti per os) e cronica (cani per os) dello steroide non procura effetti tossici. Dal punto di vista farmacocinetico il farmaco, dopo somministrazione orale nell`uomo, viene rapidamente assorbito, con picco ematico raggiunto tra 60 e 90 minuti primi e con tempo di emivita di 9,4 ore. La via di eliminazione preferenziale è quella urinaria, dove si trova nelle 24 ore il 43,6% e nelle 96 ore il 60,4% della dose somministrata. La larga parte (28,7%) della quota di sostanza somministrata viene escreta immodificata nelle urine.
Posologia e modo di somministrazione
La dose media per gli adulti è di una compressa da 2,5 mg due-quattro volte al giorno. Di regola sono sufficienti 4 settimane di trattamento. Dove se ne ravvisi la necessità, la terapia con
steroidi androgeni può essere protratta fino ad un massimo di 4-6 mesi. Dosi molto elevate di oxandrolone(oltre cento milligrammi giornalieri), pur ritenuto uno tra gli steroidi androgeni a più bassa tossicità, po’ determinare disturbi gastrointestinali, nausea, gonfiori, diarrea. Una dose di 0,250 mg/kg ( 12,5-25 mg al giorno), suddivisa in 3 somministrazioni dopo i pasti, è clinicamente efficace e sicura.
Controindicazioni
Tutti gli steroidi anabolizzanti sono controindicati nella gravidanza accertata o presunta; nel
carcinoma della prostata con alcune eccezioni. Il farmaco non deve essere usato nei casi di accertata sensibilità. L’impiego nei bambini deve rispettare le indicazioni endocrinologiche per evitare la saldatura epifisari ossea anticipata.
Effetti collaterali
La somministrazione dell’oxandrolone a dosi e durata superiori a quelle indicate può dare degli effetti indesiderati comuni a tutti gli steroidi androgeni. Il primo sintomo clinico a comparire con il sovradosaggio è la perdita della libido, dopo un periodo iniziale con un aumento dello stimolo sessuale. Un altro sintomo che può comparire di frequente è l’aumento dell’aggressività, nervosismo ed insonnia. Dopo lunghi periodi di trattamento compare la inibizione della funzione testicolare con ridotta produzione di testosterone e di spermatozoi, fino alla infertilità da oligospermia o azoospermia. Anche la comparsa di ginecomastia, epididimite e irritabilità della vescica sono spesso frequente. L’acne e la caduta dei capelli, riscontrati frequentemente per altri androgeni, per l’oxandrolone è raramente riscontrabile. La sospensione della terapia normalizza il quadro clinico in tempi brevi. Nella donna dose elevate e assunte per lunghi periodi possono determinare la comparsa di acne, la caduta dei capelli fino all’alopecia, aumento del tono della voce, l’amenorrea, segni di mascolinizzazione con aumento delle masse muscolari e del clitoride. La sospensione del farmaco determina la regressione dei sintomi.
Avvertenze
L’oxandrolone può interagire con altri farmaci, in particolare con i farmaci antidiabetici orali e l’insulina aumentandone l’effetto. Quindi nei diabetici il miglioramento del controllo glicemico può richiedere un adattamento posologico dell`insulina o degli altri farmaci ipoglicemizzanti. Nei soggetti in cura con anticoagulanti si può registrare un aumento della risposta a questi farmaci tale da richiedere una riduzione delle loro dosi per ottenere lo stesso livello di effetto terapeutico. La somministrazione contemporanea di corticosteroidi o ACTH può essere occasionalmente causa di comparsa di edema. Nel nanismo ipofisario il prodotto non sostituisce l`ormone GH del quale, anzi, in eventuali trattamenti combinati possono giovare al risultato. Gli steroidi anabolici sono da usare con cautela nei soggetti con ipertrofia della prostata. Nei pazienti affetti da cardiopatie, nefropatie o epatopatie è da tener presente la possibilità che lo steroide concorra ad accentuare la ritenzione idrico- elettrolitica e l`edema. Possono essere modificati anche alcuni test di funzionalità epatica con aumento delle transaminasi, la riduzione del colesterolo totale ed in particolare del colesterolo HDL e della fosfatasi alcalina. La funzionalità renale può variare con una aumentata escrezione di creatina e creatinina che può perdurare fino a due settimane dopo l`interruzione della terapia. A livello della coagulazione del sangue si possono riscontrare la soppressione dei fattori II, V, VII e X.
Conclusioni
L’oxandrolone è un farmaco androgeno anabolizzante di grande efficacia clinica e ben tollerato a dosi fisiologiche. Può essere impiegato clinicamente per molte patologie, particolarmente indicato nel bambino con ritardi di crescita e nella sarcopenia e atrofia muscolare dell’anziano. Il programma terapeutico deve essere seguito dal medico specialista per dosaggio e durata della somministrazione.
Bibbliografia.
Crock, P., G. A. Werther and H. N. Wettenhall (1990). “Oxandrolone increases final height in Turner syndrome.” J Paediatr Child Health 26(4): 221-224.
Crowne, E. C., W. H. Wallace, C. Moore, R. Mitchell, W. H. Robertson, J. M. Holly and S. M. Shalet (1997). “Effect of low dose oxandrolone and testosterone treatment on the pituitary-testicular and GH axes in boys with constitutional delay of growth and puberty.” Clin Endocrinol (Oxf) 46(2): 209-216.
Crowne, E. C., W. H. Wallace, C. Moore, R. Mitchell, W. R. Robertson and S. M. Shalet (1995). “Degree of activation of the pituitary-testicular axis in early pubertal boys with constitutional delay of growth and puberty determines the growth response to treatment with testosterone or oxandrolone.” J Clin Endocrinol Metab 80(6): 1869-1875.
Fenichel, G., A. Pestronk, J. Florence, V. Robison and V. Hemelt (1997). “A beneficial effect of oxandrolone in the treatment of Duchenne muscular dystrophy: a pilot study.” Neurology 48(5): 1225-1226.
Fox, M., A. S. Minot and G. W. Liddle (1962). “Oxandrolone: a potent anabolic steroid of novel chemical configuration.” J Clin Endocrinol Metab 22: 921-924.
Gault, E. J., R. J. Perry, T. J. Cole, S. Casey, W. F. Paterson, P. C. Hindmarsh, P. Betts, D. B. Dunger, M. D. Donaldson, E. British Society for Paediatric and Diabetes (2011). “Effect of oxandrolone and timing of pubertal induction on final height in Turner’s syndrome: randomised, double blind, placebo controlled trial.” BMJ 342: d1980.
Haeusler, G., K. Schmitt, P. Blumel, E. Plochl, T. Waldhor and H. Frisch (1996). “Growth hormone in combination with anabolic steroids in patients with Turner syndrome: effect on bone maturation and final height.” Acta Paediatr 85(12): 1408-1414.
Jackson, S. T., M. L. Rallison, W. H. Buntin, S. B. Johnson and R. R. Flynn (1973). “Use of oxandrolone for growth stimulation in children.” Am J Dis Child 126(4): 481-484.
Joss, E. E., P. E. Mullis, E. A. Werder, C. J. Partsch and W. G. Sippell (1997). “Growth promotion and Turner-specific bone age after therapy with growth hormone and in combination with oxandrolone: when should therapy be started in Turner syndrome?” Horm Res 47(3): 102-109.
Karim, A., R. E. Ranney, J. Zagarella and H. I. Maibach (1973). “Oxandrolone disposition and metabolism in man.” Clin Pharmacol Ther 14(5): 862-869.
Kuhn, C. M. (2002). “Anabolic steroids.” Recent Prog Horm Res 57: 411-434.
Lampit, M. and Z. Hochberg (2003). “Androgen therapy in constitutional delay of growth.” Horm Res 59(6): 270-275.
Link, K., R. M. Blizzard, W. S. Evans, D. L. Kaiser, M. W. Parker and A. D. Rogol (1986). “The effect of androgens on the pulsatile release and the twenty-four-hour mean concentration of growth hormone in peripubertal males.” J Clin Endocrinol Metab 62(1): 159-164.
Loche, S., C. Pintor, P. Cambiaso, A. Lampis, D. Carta, R. Corda and M. Cappa (1991). “The effect of short-term growth hormone or low-dose oxandrolone treatment in boys with constitutional growth delay.” J Endocrinol Invest 14(9): 747-750.
Menke, L. A., T. C. Sas, S. M. de Muinck Keizer-Schrama, G. R. Zandwijken, M. A. de Ridder, R. J. Odink, M. Jansen, H. A. Delemarre-van de Waal, W. H. Stokvis-Brantsma, J. J. Waelkens, C. Westerlaken, H. M. Reeser, A. S. van Trotsenburg, E. F. Gevers, S. van Buuren, P. H. Dejonckere, A. C. Hokken-Koelega, B. J. Otten and J. M. Wit (2010). “Efficacy and safety of oxandrolone in growth hormone-treated girls with turner syndrome.” J Clin Endocrinol Metab 95(3): 1151-1160.
Menke, L. A., T. C. Sas, G. R. Zandwijken, M. A. de Ridder, T. Stijnen, S. M. de Muinck Keizer-Schrama, B. J. Otten and J. M. Wit (2010). “The effect of oxandrolone on body proportions and body composition in growth hormone-treated girls with Turner syndrome.” Clin Endocrinol (Oxf) 73(2): 212-219.
Orr, R. and M. Fiatarone Singh (2004). “The anabolic androgenic steroid oxandrolone in the treatment of wasting and catabolic disorders: review of efficacy and safety.” Drugs 64(7): 725-750.
Przkora, R., D. N. Herndon and O. E. Suman (2007). “The effects of oxandrolone and exercise on muscle mass and function in children with severe burns.” Pediatrics 119(1): e109-116.
Romeyn, M. and N. Gunn, 3rd (2000). “Resistance exercise and oxandrolone for men with HIV-related weight loss.” JAMA 284(2): 176; author reply 177.
Rosenfeld, J., R. M. King and J. E. Smith (2000). “Oxandrolone in ALS: preliminary analysis.” Amyotroph Lateral Scler Other Motor Neuron Disord 1 Suppl 4: 21-25; discussion 25-26.
Ross, J. L., M. M. Mazzocco, H. Kushner, K. Kowal, G. B. Cutler, Jr. and D. Roeltgen (2009). “Effects of treatment with oxandrolone for 4 years on the frequency of severe arithmetic learning disability in girls with Turner syndrome.” J Pediatr 155(5): 714-720.
Schmitt, K., G. Hausler, P. Blumel, E. Plochl, T. Waldhor and H. Frisch (1997). “The influence of growth hormone monotherapy and growth hormone in combination with oxandrolone or testosterone on thyroxid hormone parameters and thyroxine binding globulin in patients with Ullrich-Turner syndrome.” Eur J Pediatr 156(2): 99-103.
Stahnke, N., E. Keller, H. Landy and G. Serono Study (2002). “Favorable final height outcome in girls with Ullrich-Turner syndrome treated with low-dose growth hormone together with oxandrolone despite starting treatment after 10 years of age.” J Pediatr Endocrinol Metab 15(2): 129-138.
Strawford, A., T. Barbieri, M. Van Loan, E. Parks, D. Catlin, N. Barton, R. Neese, M. Christiansen, J. King and M. K. Hellerstein (1999). “Resistance exercise and supraphysiologic androgen therapy in eugonadal men with HIV-related weight loss: a randomized controlled trial.” JAMA 281(14): 1282-1290.
Zeger, M. P., K. Shah, K. Kowal, G. B. Cutler, Jr., H. Kushner and J. L. Ross (2011). “Prospective study confirms oxandrolone-associated improvement in height in growth hormone-treated adolescent girls with Turner syndrome.” Horm Res Paediatr 75(1): 38-46.